SPEED DATA CONTEST
Communications orales (speed data)
Congrès du Collège National des Cardiologues des Hôpitaux
Paris – 26 et 27 Novembre 2020
CARDIOPATHIE CONGÉNITALE CHEZ L’ADULTE
1/ Une hypertension pas vraiment pulmonaire
A. MELIANI1, S. HASCOET1, E. BELLI1, S. COHEN1.
1 Département de cardiopathies congénitales de l’enfant et de l’adulte. Centre de Référence des Cardiopathies Congénitales Complexes M3C – Hôpital Marie Lannelongue.
Introduction : Le ventricule droit à double chambre (VDDC) est une anomalie cardiaque dans laquelle le ventricule droit (VD) est divisé en deux chambres par une bande fibro-musculaire: une chambre d’admission à haute pression, en amont de l’obstacle et une chambre d’éjection à faible pression(1). Cette anomalie est associée dans 90% des cas à la présence d’une communication inter-ventriculaire (CIV)(2). Le diagnostic et la prise en charge chirurgicale sont généralement réalisés dans l’enfance, mais parfois la pathologie se révèle à l’âge adulte(3).
Observation : Une patiente de 30 ans est admise pour cathétérisme cardiaque devant une suspicion d’hypertension pulmonaire sévère (HTP) découverte en cours de grossesse à 29 semaines d’aménorrhée. Elle a comme antécédent une CIV infundibulaire connue depuis l’enfance sans indication chirurgicale et en rupture de suivi depuis 10 ans.
Elle est asymptomatique. L’examen clinique retrouve un souffle systolique 3/6 au bord gauche du sternum, sans éclat du B2 et, sans signes d’insuffisance cardiaque. L’ECG présente des signes de surcharge droite.
L’ETT retrouve une oreillette droite (OD) dilatée avec une fuite tricuspide minime véloce à >5m/s soit un gradient OD-VD >120mmHg. Le VD est hypertrophié de bonne fonction systolique avec une courbure septale inversée, écrasant le ventricule gauche, témoignant de pressions VD élevées. On visualise au niveau de l’infundibulum VD une bandelette fibromusculaire réalisant un obstacle fixe intra-VD. Le passage du flux sanguin à son niveau est étroit avec une accélération au travers > 6 m/sec soit un gradient maximum de 140 mmhg. Les pressions pulmonaires sont basses sur le flux d’insuffisance pulmonaire. Aucun shunt de CIV n’est visualisé (Figure 1).
Le diagnostic de VDDC est évoqué puis confirmé au cathétérisme cardiaque qui retrouve une hypertension ventriculaire droite en relation avec un obstacle infundibulaire pulmonaire sévère par une bande fibro-musculaire (Figure 2). La pression dans la chambre d’admission VD est de 230 mmHg pour un gradient à travers l’obstacle à 200 mmHg. La pression artérielle pulmonaire moyenne est basse à 13 mm Hg (Figure 3). Le scanner réalisé avant son admission retrouve a posteriori les mêmes images (Figure 2).
La discussion pluridisciplinaire médico-chirurgico-obstetricale et pédiatrique contre-indique la voie basse devant le risque de mauvaise tolérance hémodynamique lors d’efforts de poussée et une césarienne est organisée à 34SA en milieu chirurgical cardiaque spécialisé avec possibilité d’assistance voire de chirurgie cardiaque urgente en cas de dégradation hémodynamique. Devant la majoration de l’obstacle en échocardiographie, l’apparition d’une dyspnée d’effort et d’extra systoles ventriculaires, la césarienne est finalement réalisée à 32 SA, sous anesthésie générale, avec bonne tolérance hémodynamique.
La patiente a été opérée de façon élective à 3 mois post partum. La cure chirurgicale a consisté en une résection de l’obstacle médioventriculaire et d’une plastie tricuspide par atriotomie droite, sous CEC de 33 mn, Clampage aortique de 21 mn, reperfusion de 6 mn (figure 4) avec des suites post-opératoires simples.
L’échographie à un mois post-opératoire retrouve un ventricule droit libre, sans obstacle résiduel, une diminution de l’hypertrophie ventriculaire droite une courbure septale normale, PVDS (pression ventriculaire droite systolique) à 24 mmhg sur le flux d’IT (insuffisance tricuspide) (figure 5). La patiente rapporte par ailleurs, une nette amélioration fonctionnelle
Discussion : Ce cas clinique illustre la nécessité d’un suivi à l’âge adulte des patients porteurs de CIV même sans retentissement dans l’enfance devant le risque de complications tardives parfois asymptomatiques. Ainsi la prise en charge pourra être faite de façon élective en dehors de situations à risques tel que la grossesse.
Conclusion : Une hypertension ventriculaire droite ne traduit pas toujours une HTP, ne pas méconnaitre les obstacles intra VD compliquant des cardiopathies congénitales.
Références :
1. Choi YJ, Park SW. Characteristics of double-chambered right ventricle in adult patients. Korean J Intern Med. 2010;25(2):147–53.
2. Hoffman P, Wójcik AW, Rózański J, Siudalska H, Jakubowska E, Włodarska EK, et al. The role of echocardiography in diagnosing double chambered right ventricle in adults. Heart. 2004;90(7):789–93.
3. McElhinney DB, Chatterjee KM, Reddy VM. Double-chambered right ventricle presenting in adulthood. Ann Thorac Surg. 2000;70(1):124–7.
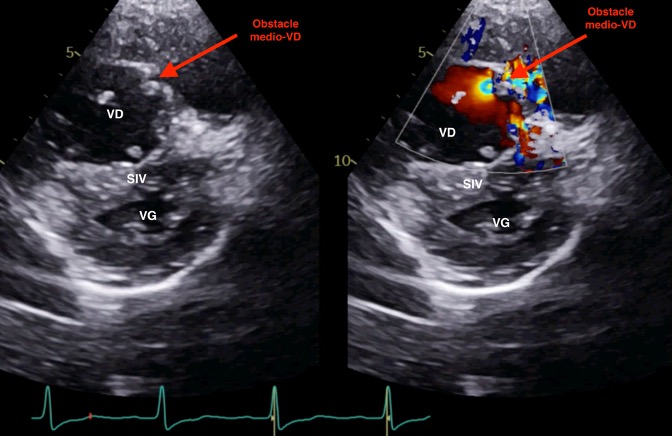
Figure 1. Coupe ETT parasternale petit axe montant l’obstacle médio-VD et la courbure septale aplatie (image de gauche) et doppler couleur montrant un aliasing à travers l’obstacle témoignant de flux véloces et hautes pressions (image de droite). (VD : ventricule droit, VG : ventricule gauche, SIV : septum interventriculaire)
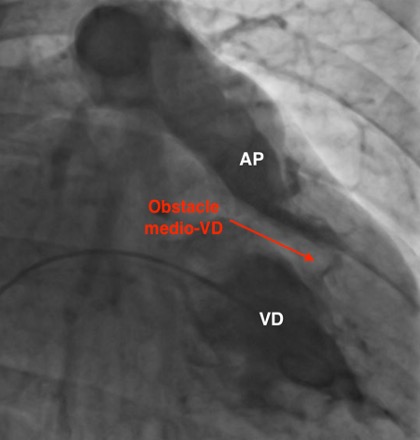
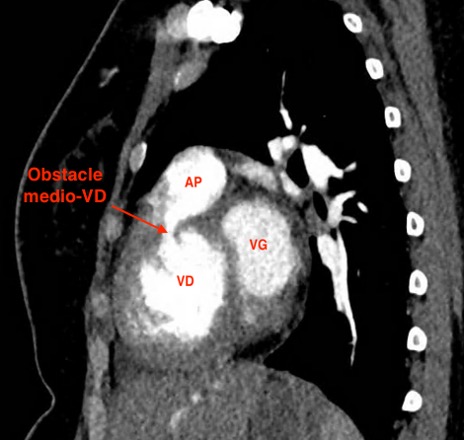
Figure 2. Obstacle médio-VD visualisé en angiographie et au scanner (AP : Artère pulmonaire), hypertrophie VD visible au TDM
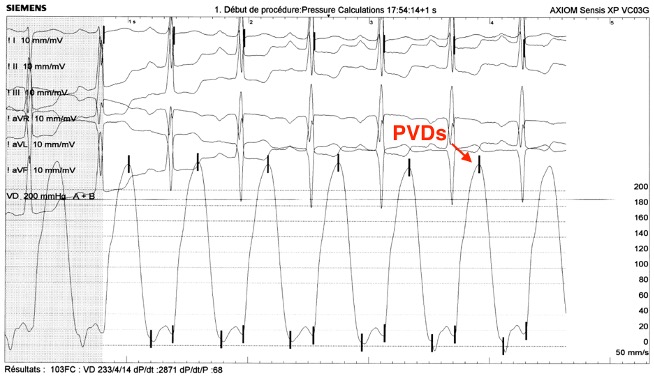
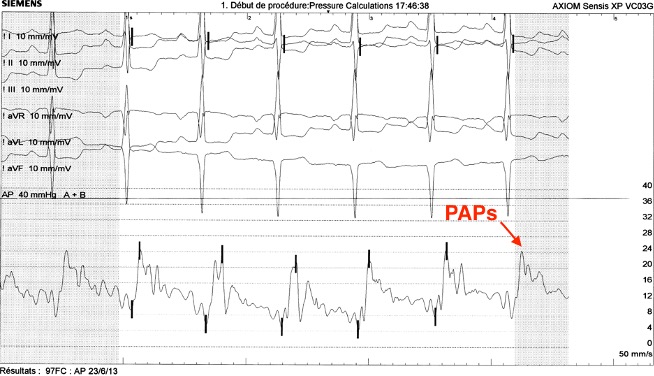
Figure 3. Courbes de pressions au cathétérisme (VD en haut, AP en bas, PAPs : pressions artérielle pulmonaire systolique, PVDs pressions ventriculaire droite systolique)
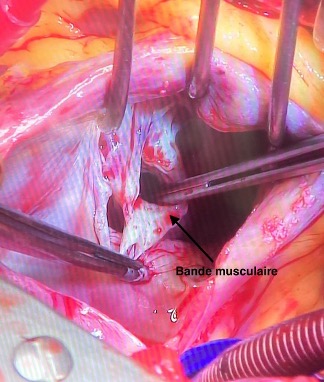
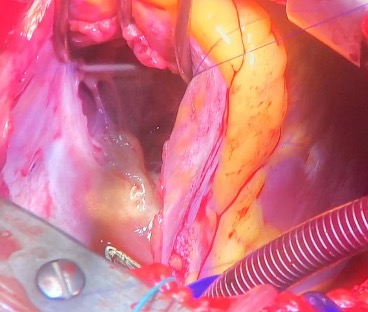
Figure 4 : photographies per-opératoires montrant l’obstacle médio-VD avant (en haut) et après (en bas) résection chirurgicale. Vue de l’atriotomie droite.
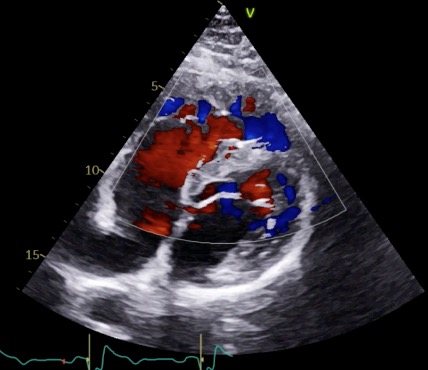
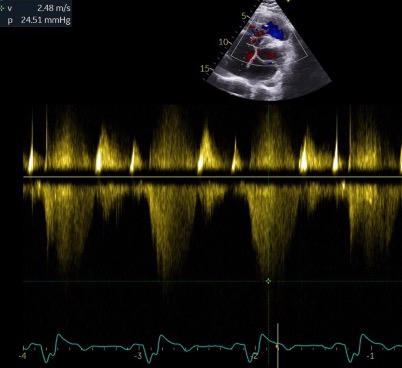
Figure 5 : ETT post-opératoire montrant l’absence d’obstacle résiduel en doppler couleur (en haut) et la normalisation de la PVDS sur le flux d’IT (en bas).
*Auteur Correspondant : a.meliani@hml.fr
Pas de conflit d’intérêt
COVID ET CARDIOPATHIE
2/ Tamponnade & COVID-19
SAUER François1, DAGRENAT Charlotte1, LEDDET Pierre1, et al.
1 Pôle de Cardiologie, Centre Hospitalier 67500 Haguenau
Mots clés : Tamponnade, SARS-Coronavirus-2, Myo-péricardite
Introduction : L’infection à SARS-Coronavirus-2 (COVID-19) est une pandémie touchant des milliers de personnes et fait l’objet de nombreuses publications du fait de ses présentations cliniques multiples.
Examen clinique : Nous rapportons le cas d’un homme de 51 ans présentant depuis 1 mois une douleur thoracique évocatrice de péricardite suivie d’une altération de l’état général et d’une dyspnée au moindre effort. Il présente comme antécédent un asthme d’effort et un tabagisme actif.
Le 01/04/2020, il est pris en charge aux urgences. Son examen clinique retrouve une tension artérielle à 106/60 mmHg, une fréquence cardiaque à 108 battements par minute, une température corporelle à 36° et une saturation à 94% en air ambiant (AA). La biologie objective une insuffisance rénale aigue avec urée à 10.1 mmol/L, créatinine à 172 micromol/L (DFG-CKD-EPI 39 mL/min/m²), un syndrome inflammatoire avec une CRP à 223 mg/L et une polynucléose neutrophiles (11.8 G/L) et une cholestase à 2 fois la normale. Le pic de troponine HS est à 919 ng/L (norme < 78.5). La gazométrie artérielle en AA retrouve une hypoxémie isolée à 62 mmHg. L’ECG inscrit un microvoltage associé à un sus-décalage diffus du segment ST. Le scanner thoracique montre une atteinte typique modérée à COVID-19 et un épanchement péricardique circonférentiel, mesuré à 22 millimètres et compressif à l’échocardiographie trans-thoracique. Au décours du scanner, le patient présente une détresse respiratoire motivant une oxygénothérapie à 10L/min et une ponction péricardique sous-xiphoïdienne en urgence. Cette dernière retire 800 mL de liquide séro-hématique.
L’évolution clinico-biologique est rapidement favorable avec disparition des douleurs thoraciques et normalisation de la biologie. Le patient rentre à domicile à J7 sous traitement par COLCHICINE (0.5 mg 2 fois par jour) introduite à J3.
Les sérologies (VIH, VHB, VHC, EBV, CMV, Adenovirus, Picornavirus, Parvovirus B19) et le frottis naso-pharyngé COVID-19 sont négatifs. L’épanchement péricardique est un exsudat avec de rares lymphocytes sans cellules malignes. On note une contamination à Propionibacterium Acnes. Une IRM cardiaque à J7 objective une péricardite sans myocardite associée.
Nous concluons à une tamponnade avec tableau de choc compliquant une myo-péricardite aigue à COVID-19. Après revue de la littérature, nous retrouvons un cas similaire en Italie1 également mal toléré avec nécessité de ponction en urgence. La mauvaise tolérance et l’évolution vers ce tableau clinique pourraient être expliquées par la décharge cytokinique inflammatoire liée au virus. L’atteinte péricardique semble rare mais reste non quantifiée, à ce jour. Les différentes études radiologiques relèvent des épanchements péricardiques peu fréquents2. Sur le plan thérapeutique, l’introduction d’anti-inflammatoire non stéroïdiens semble contre-indiquée compte tenu du risque d’aggravation respiratoire. La Colchicine a une place reconnue dans le traitement des péricardites et pourrait représenter une thérapeutique intéressante par le blocage de l’assemblage des inflammasomes NLRP3 et de la libération des cytokines3.
Les limites de ce case report sont l’absence de confirmation diagnostique de COVID-19 au frottis naso-pharyngé (sensibilité de 59%4) et l’absence d’analyse virologique du liquide péricardique.
Conclusion : Toute dégradation inexpliquée de l’état hémodynamique d’un patient COVID-19 doit faire rechercher une myo-péricardite, notamment par échocardiographie trans-thoracique.
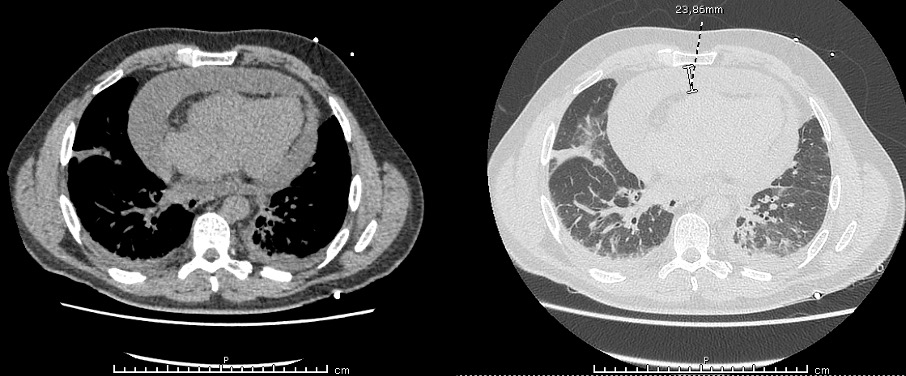
Figure 1. Scanner thoracique sans injection, non synchronisé à l’ECG. Coupe axiale. Volumineux épanchement péricardique. Aspect évocateur d’infection à SARS-Coronavirus-19 : verre dépoli en plage et nodulaire avec condensation en bande, topographie sous pleurale bilatérale.
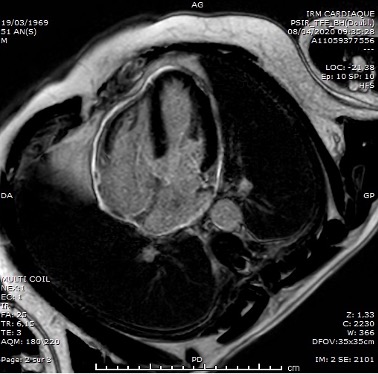
Figure 2. IRM cardiaque, séquence de rehaussement tardif. Coupe 4 cavités. Hypersignal péricardique circonférentiel.
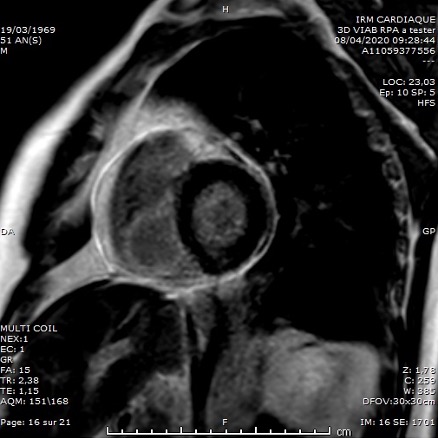
Figure 3. IRM cardiaque, séquence de rehaussement tardif. Coupe petit axe. Hypersignal péricardique circonférentiel.
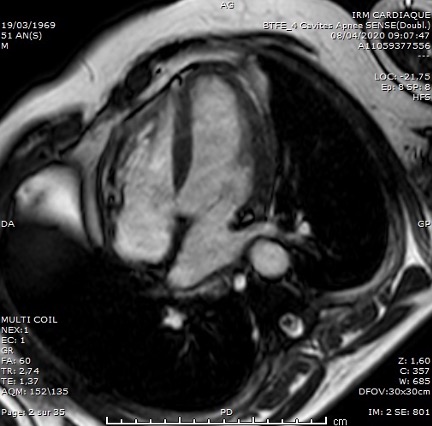
Figure 4. IRM cardiaque, séquence ciné. Coupe 4 cavités. Absence d’épanchement péricardique post-drainage.
Bibliographie :
1. Hua A, O’Gallagher K, Sado D, Byrne J. Life-threatening cardiac tamponade complicating myo-pericarditis in COVID-19. Eur Heart J. 2020 Mar 30. pii: ehaa253.
2. Sana Salehi, Aidin Abedi, Sudheer Balakrishnan and Ali Gholamrezanezhad. Coronavirus Disease 2019 (COVID-19): A Systematic Review of Imaging Findings in 919 Patients. American Journal of Roentgenology: 1-7. 10.2214/AJR.20.23034
3. Deftereos SG, Siasos G, Giannopoulos G. The Greek study in the effects of colchicine in COvid-19 complications prevention (GRECCO-19 study): Rationale and study design. Hellenic J Cardiol. 2020 Apr 3.
4. Ai T, Yang Z, Hou H. Correlation of Chest CT and RT-PCR Testing in Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology. 2020 Feb 26:200642.
*Auteur Correspondant : sauer.francois@gmail.com
Pas de conflit d’intérêt
3/ Impact du traitement par IEC/ARA2 chez les patients hospitalisés pour
Covid-19 : une étude de cohorte.
Anis SAIB1, Lee S NGUYEN2, Walid AMARA1, Ahmed FEKI1, Olivier NALLET1
1 Groupe Hospitalier Intercommunal Le Raincy-Montfermeil, Service de Cardiologie, 93370
2 Hôpital Cochin, Service de Réanimation ,75014
Introduction : L’épidémie de Covid-19 a frappé la France dès février 2020. Selon certains auteurs, près de 40% des patients hospitalisés présentaient une comorbidité cardiovasculaire (1), dont l’hypertension artérielle, le diabète et la cardiopathie ischémique sont parmi les plus fréquentes. Or ces patients sont souvent traités par des Inhibiteur de l’Enzyme de Conversion ou Antagonistes du Récepteur Angiotensine Aldostérone (IEC/ARA2).
Rapidement la communauté médicale a été préoccupée par une éventuelle interaction entre le virus Sars-Cov-2 et le traitement par IEC/ARA2, certains appelant à les arrêter préventivement en cas de contamination (2).
En effet, sur des modèles animaux, le traitement par IEC /ARA 2, augmente l’expression cellulaire membranaire de l’Enzyme de Conversion de l’Angiotensine 2 (ACE2) (3), récepteur auquel le virus SARS cov-2 se lie au niveau de l’épithélium respiratoire.
Le traitement par IEC/ARA 2 pourrait donc potentiellement aggraver les manifestations respiratoires du Covid-19 avec un sur-risque de syndrome de détresse respiratoire aigue et mortalité (2).
L’objectif de notre étude était d’évaluer l’impact du traitement par IEC/ARA2 à l’admission sur la mortalité à 28 jours chez les patients hospitalisés pour Covid-19.
Matériels et méthodes : Il s’agissait d’une étude observationnelle, rétrospective, sur un registre prospectif soumis à accord du Comité de Protection des Personnes (CPP) au sein de l’Hôpital de Montfermeil. Les patients inclus étaient hospitalisés pour Covid-19 entre le 15 mars 2020 et le 2 avril 2020.
Le critère de jugement principal était la mortalité à 28 jours de l’hospitalisation. Les critères de jugement secondaires étaient l’hospitalisation en soins intensifs, l’intubation orotrachéale à 28 jours de l’hospitalisation, l’arrêt du traitement IEC/ARA 2 à l’admission. Le suivi était complet pour 97,3% des patients.
Résultats : 263 patients ont été inclus, l‘âge médian était de 59,5 ans avec 41,4 % de patients de sexe féminins, 119 (45,2%) des patients hospitalisés étaient hypertendus.
Parmi les patients inclus, 67 (25,5%) étaient sous IEC/ARA2 à l’admission et comparés à 196 (74,5%) qui ne l’étaient pas.
Durant le suivi de 28 jours, 40 (15,2 %) patients sont décédés. Le traitement par IEC/ARA2 n’impactait pas la mortalité à 28 jours (19,7% vs 13,8% log rank p=0,54) comme représenté sur la figure 1. On ne constatait pas de différence statistiquement significative entre les deux groupes pour l’hospitalisation en soins intensifs (24,2% vs 18,4% p=0,30) et l’intubation orotrachéale (15,2% vs 9,7% p=0,25) à 28 jours de l’admission. Le traitement par IEC ARA2 a été arrêté à l’admission pour 28 (41.8 %) patients.
Conclusion : Le traitement par IEC/ARA2 n’était pas associé à une augmentation de la mortalité après un suivi de 28 jours chez les patients hospitalisés pour Covid-19. Ces données ne sont pas en faveur d’un arrêt systématique des IEC/ARA2 en accord avec les consensus d’experts des sociétés savantes.
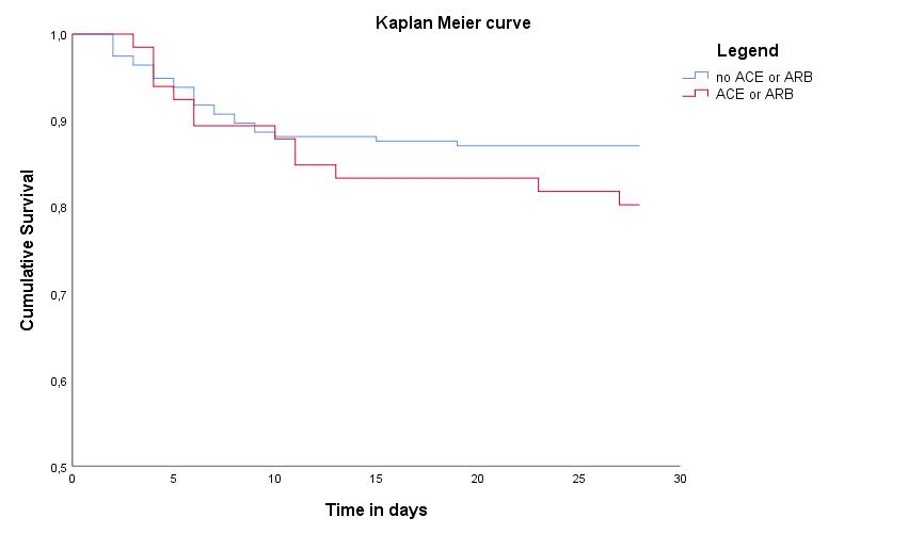
Figure 1. Courbe de Kaplan Meier comparant les groupes IEC/ARA 2 et contrôle avec 28 jours de suivi.
Références :
1. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet. 2020;395(10223):507-513. doi:10.1016/S0140-6736(20)30211-7
2. Fang L, Karakiulakis G, Roth M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med 2020 Mar 11. pii: S2213-2600(20)30116-8
3. Ferrario CM, Jessup J, Chappell MC, et al. Effect of Angiotensin-Converting Enzyme Inhibition and Angiotensin II Receptor Blockers on Cardiac Angiotensin-Converting Enzyme 2. Circulation. 2005;111(20):2605-2610. doi:10.1161/CIRCULATIONAHA.104.510461
*Auteur Correspondant : drsaibanis@gmail.com
Pas de conflit d’intérêt.
CORONAROPATHIE
4/ Étiologies, prise en charge diagnostique et thérapeutique des patients avec douleur thoracique et élévation de troponine sans lésion coupable à la coronarographie
P. Brami1, D. Millischer1, A. Feki1, B. Safar1, O. Nallet1
1 Service de Cardiologie – GHI Le Raincy Montfermeil, 93370 Montfermeil
Introduction : Parmi les patients avec une douleur thoracique et élévation de troponine, il est difficile à la phase initiale de leur prise en charge d’identifier ceux qui ont une souffrance myocardique de cause ischémique. Une coronarographie est alors souvent pratiquée afin de ne pas méconnaitre un infarctus du myocarde (IDM) mais elle ne retrouve pas toujours de lésion coupable.
Objectifs : Évaluer les étiologies responsables de douleur thoracique avec élévation de troponine significative sans lésion coupable à la coronarographie et évaluer nos pratiques de prise en charge diagnostique et thérapeutique de ces patients.
Matériels et méthodes : Notre étude était rétrospective portant sur une cohorte de patients consécutifs ayant eu une coronarographie pour suspicion d’IDM sans lésion coupable retrouvée. Nous avons recherché le diagnostic étiologique retenu à l’issue du bilan étiologique effectué et analysé leur prise en charge thérapeutique médicamenteuse.
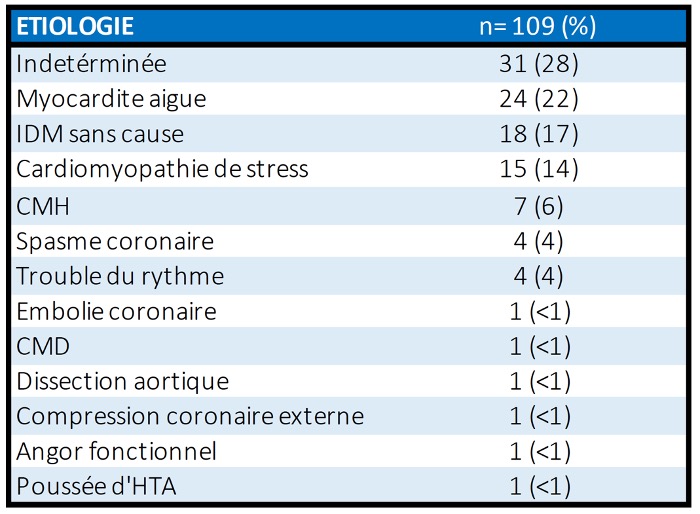
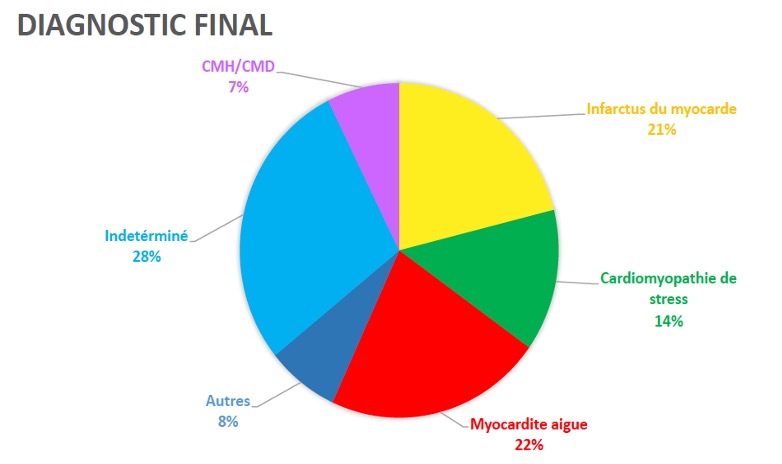
Résultats : Sur les 1889 coronarographies réalisées pour suspicion d’IDM entre janvier 2015 et aout 2018, 109 (5,8%) ne retrouvaient pas de lésion angiographiquement coupable. On retrouve une surreprésentation féminine (51%) dans cette population comparée aux registres de patients coronariens où habituellement seulement un quart sont de sexe féminin. Elle diffère également sur les facteurs de risque cardiovasculaires avec une proportion moins importante de diabétiques (11% versus 27%), dyslipidémiques (22% versus 54%) pour un âge moyen plus jeune (57ans versus 68 ans) et un pic de troponine moins élevé. A l’issue du bilan diagnostique : l’étiologie est restée indéterminée dans 29% des cas. Les principaux diagnostics étaient les myocardites aigues (22%), les IDM aussi appelés « MINOCA » (21%) regroupant diverses causes (rupture/érosion de plaque, spasme, embolie, dissection spontanée), les cardiomyopathies de stress/Tako-Tsubo (14%) et les cardiomyopathies hypertrophiques ou dilatées (7%). L’IRM myocardique était l’examen le plus prescrit dans le bilan diagnostic (62%) ; elle permettait d’établir un diagnostic étiologique dans 85% des cas dont la majorité des IDM. La ventriculographie (17%), le test au Methergin (7%), l’OCT (3%) et l’ETO (1%) étaient peu réalisés. En l’absence d’étiologie retrouvée, les traitements les plus introduits étaient une antiagrégation plaquettaire (45%), un bétabloquant (38%) et une statine (39%) malgré l’absence de recommandation.
Conclusion : Chez les patients avec douleur thoracique et élévation de la troponine, la coronarographie ne retrouve pas de lésion dans 5,8% des cas. L’étiologie reste indéterminée dans 29% des cas. Les autres étiologies les plus fréquentes sont les myocardites aigues, les IDM à coronaires saines, les cardiomyopathies de stress et les cardiomyopathies hypertrophiques ou dilatées. Bien qu’il n’existe pas de bilan étiologique standardisé, l’IRM myocardique est un examen avec forte rentabilité diagnostique chez ces patients qui doivent être revus précocement à l’issue du bilan pour adapter la prise en charge thérapeutique en fonction de l’étiologie retenue.
*Auteur Correspondant : pierrebrami25@gmail.com
Pas de conflit d’intérêt
5/ Une cause rare d’infarctus du myocarde sans sus décalage du segment ST de
type 2 : compression cardiaque et obstruction intraventriculaire gauche par une volumineuse hernie hiatale
L. Salvati1, S. Atesler2, M. Valla2
1 Interne en cardiologie à la faculté de médecine de Nancy.
2 Service de cardiologie du CHR Metz – Thionville, site de Mercy.
Mots clés : hernie hiatale, obstruction ventriculaire gauche, syndrome coronarien aigu, sus-décalage du segment ST
Introduction : Les hernies hiatales volumineuses peuvent se compliquer de divers tableaux cardiologiques, en particulier via un mécanisme compressif.
Les symptômes peuvent être chroniques, à type de dyspnée d’effort notamment.
Des tableaux aigus sont aussi rapportés dans la littérature, souvent suite à des repas copieux, et sont alors généralement accompagnés de vomissements.
Nous rapportons ici le cas d’une patiente de 89 ans, ayant présenté un tableau de syndrome coronarien aigu intra-hospitalier.
Examen clinique : Mme P. est une femme de 89 ans, connue pour une hernie hiatale paucisymptomatique et amenée aux urgences pour épigastralgies fluctuantes depuis 15 jours et vomissements.
La pression artérielle est à 136/75 mmHg, on ne retrouve pas de signe clinique d’insuffisance cardiaque.
L’électrocardiogramme initial retrouve un segment ST suspendu en aVR (Figure 1A).
Biologiquement, la troponinémie est légèrement supérieure à la normale (32 ng/mL pour une norme à 14 ng/mL).
La radiographie thoracique montre une poche à air gastrique anormalement haute (Figure 2A).
Un scanner thoraco-abdominal est réalisé et retrouve une volumineuse hernie hiatale contenant l’estomac, très dilaté, le pancréas et l’angle colique gauche (Figure 2B).
Immédiatement après le scanner, Mme P. présente une récidive brutale d’épigastralgie et une hypotension artérielle, associées à une tachycardie sinusale. L’ECG retrouve un sus-décalage du segment ST en aVR, associé à un sous-décalage diffus du segment ST (Figure 1B).
La patiente bénéficie alors d’une coronarographie en urgence, qui s’avère normale (Figure 3).
L’échocardiographie transthoracique met alors en évidence, outre de nombreux artefacts liés à la situation intrathoracique de l’estomac, un aspect de refoulement du coeur par la hernie, responsable d’un gradient de pression intraventriculaire gauche (atteignant 40-45 mmHg), en l’absence de cardiopathie hypertrophique sous-jacente.
Après 48h de jeûne, réhydratation et aspiration nasogastrique, on constate une normalisation de l’électrocardiogramme (Figure 1C), de la troponinémie, et une nette régression de l’obstruction intraventriculaire gauche, contrôlée à 8 mmHg (Figure 4A).
La correction chirurgicale de la hernie, théoriquement indiquée, n’a pas été réalisée en raison de l’état général de cette patiente de 89 ans. Des règles hyginénodiététiques ont été préconisées : repas légers, lutte contre les facteurs à l’origine d’une augmentation de la pression intra-abdominale (notamment contre la constipation), éviter le décubitus en période post-prandiale.
Discussion : Les compressions cardiaques ont été décrites dans la littérature comme des complications rares de hernies hiatales volumineuses.
La situation la plus étudiée est la compression de l’oreillette gauche et/ou des veines pulmonaires, situées juste en avant du hiatus oesophagien. Elle réalise au maximum un tableau de “tamponnade gastrique” avec adiastolie et chute du débit cardiaque, d’évolution favorable sous remplissage vasculaire et drainage gastrique (1).
Chez notre patiente, la compression de l’oreillette gauche était modérée (Figure 4B). La totalité de l’estomac étant en situation sus-diaphragmatique, on peut penser que la compression s’est exercée de manière globale sur le coeur (notamment sur le ventricule gauche), et non pas préférentiellement sur les structures jouxtant le hiatus oesophagien.
Des tableaux de syndromes coronaires aigus ou chroniques, accompagnés de modifications électriques comme chez Mme P. ont été rapportés, allant de l’angor d’effort au syndrome coronarien aigu avec sus-décalage du segment ST (2).
Les mécanismes impliqués dans le syndrome coronarien présenté par Mme P. semblent multiples : à l’éventuelle compression transitoire d’un ou plusieurs troncs coronaires épicardiques par la hernie s’associent l’augmentation de la consommation en oxygène du myocarde dans un contexte de pré-tamponnade gastrique et d’obstruction intraventriculaire gauche.
Une obstruction intraventriculaire gauche attribuable à une hernie hiatale compressive n’a été rapportée que par une équipe japonaise chez un patient de 76 ans qui présentait un gradient de 77 mmHg régressant spontanément et complètement à distance du repas (3), à la différence de l’obstruction constatée chez Mme P. qui persistait a minima.
Conclusion : Les hernies hiatales volumineuses peuvent conduire à des tableaux d’ischémie myocardique ou de choc cardiogénique obstructif.
Cause rare, il faut néanmoins l’évoquer en cas de hernie hiatale connue, de vomissements ou de symptômes post prandiaux.
1. Morita S, Sakurai K, Watanabe Y, Nishino T. Obstructive Shock Caused by a Giant Hiatus Hernia. Intern Med. 2014;53(23):2755‑2755.
2. Brown A, Austin D, Kanakala V. Cardiac compression due to gastric volvulus: an unusual cause of chest pain. BMJ Case Rep [Internet]. 22 mai 2017 [cité 20 avr 2020];2017. Disponible sur: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5753695/
3. Harada K, Tamura U, Ichimiya C, Terada N, Yokoyama Y, Kageyama N, et al. Left ventricular obstruction caused by a large hiatal hernia. Echocardiography. 2017;34(8):1254‑6.
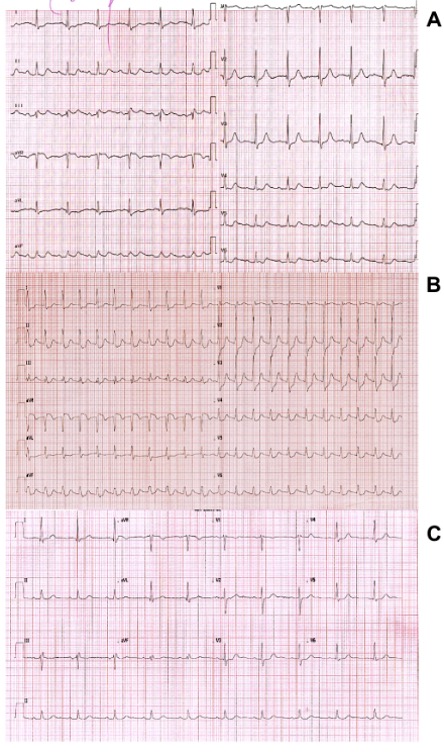
Figure 1. Evolution du tracé électrocardiographique à l’admission (A), immédiatement après le scanner (B), puis après mise à jeun et drainage gastrique (C) : troubles de repolarisation diffus millimétriques, s’aggravant sur le 2e ECG, avec une tachycardie sinsuale, puis régression complète des signes ECG après le drainage gastrique.
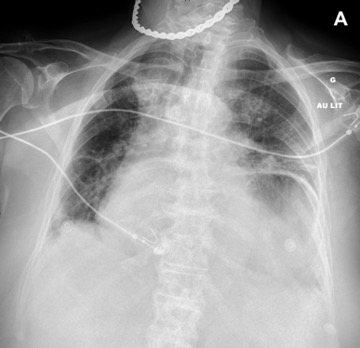
Figure 2. Radiographie pulmonaire de face (A) et scanner thoraco-abdominal en coupe axiale et frontale (B) montrant une volumineuse hernie hiatale comprimant la paroi latérale du ventricule gauche.
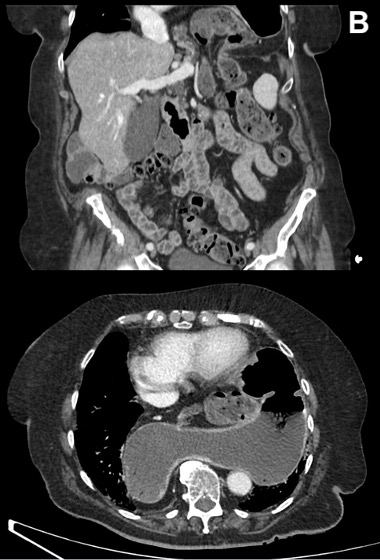
Figure 3. Coronarographie normale
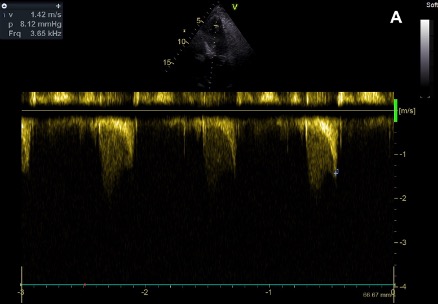
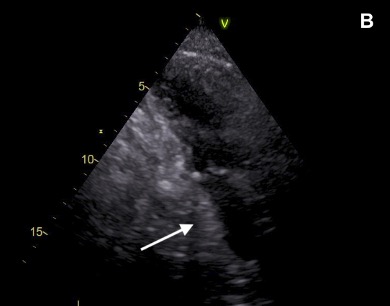
Figure 4. Contrôle échocardiographique à 48h, retrouvant un gradient de pression intraventriculaire gauche mesuré en doppler continu, persistant a minima à après drainage gastrique (A) ainsi qu’une compression modérée de l’oreillette gauche (B, compression indiquée par la flèche).
*Auteur Correspondant : lu.k.salvati@gmail.com
Pas de conflit d’intérêt
6/ Une douleur thoracique suspecte…
GROBOST-DALBIN Emma1
1 Service de cardiologie, Centre Hospitalier de Niort, 79000 Niort
Cas clinique : Il s’agit d’un patient de 28 ans, fumeur sevré, présentant une hérédité coronarienne, qui consulte pour des douleurs thoraciques atypiques. L’examen clinique, l’ECG, la RP sont normaux. Le bilan biologique montre une troponine à 0.14ng/ml (N<0.04ng/ml) et une CRP augmentée à 21mg/l. L’ETT montre une minime lame d’épanchement
péricardique. Devant la suspicion de myopéricardite, nous introduisons un traitement par Aspirine, Colchicine, Bisoprolol et Ramipril. Pour ne pas méconnaitre une origine coronarienne, nous réalisons un scanner cardiaque qui montre une naissance de l’artère coronaire droite dans le sinus antéro-gauche (ARCA) avec trajet initial inter aorto-pulmonaire.
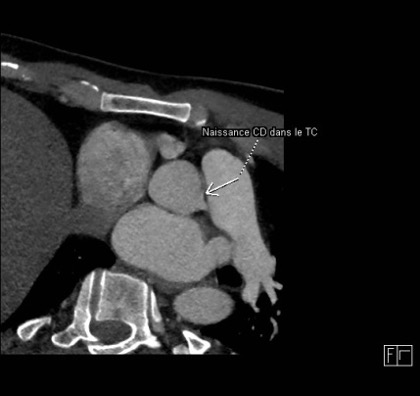
Figure 1. Scanner coronaire retrouvant une ARCA.
Nous arrêtons les traitements instaurés pour la suspicion de myopéricardite, et, réalisons une coronarographie confirmant l’ARCA au niveau de l’ostium du tronc commun avec une coronaire droite dominée.
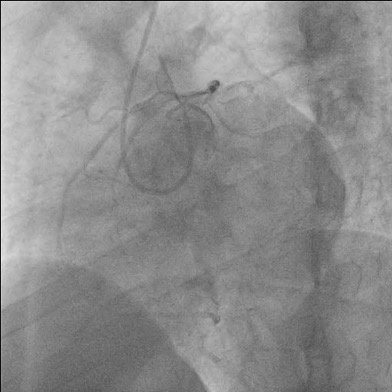
Figure 2. Coronarographie retrouvant l’ARCA
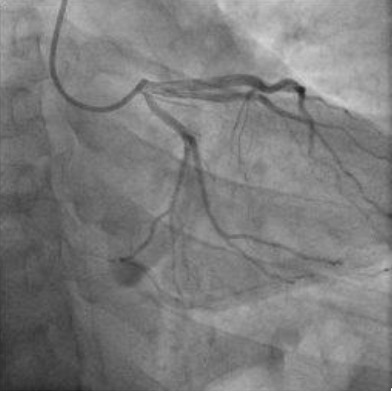
Figure 3. Réseau gauche sain.
A 48h de l’arrêt des traitements, Mr B. présente une récidive des douleurs thoraciques avec ascension de la troponine à 1,52 ng/ml, sans modification ECG. Une IRM cardiaque met en évidence un rehaussement tardif sous-épicardique latéral confirmant la myocardite.
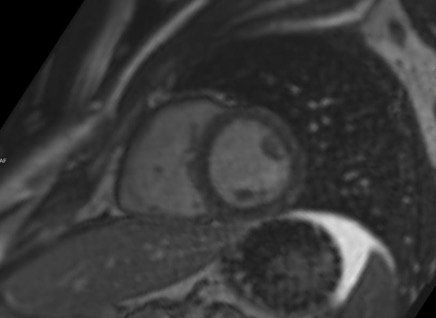
Figure 4. Rehaussement sous-épicardique latéral en IRM cardiaque.
Nous avons donc fait la découverte fortuite d’une anomalie de naissance de la coronaire droite interartérielle dans un contexte de myocardite (expliquant les douleurs thoraciques). En staff médico-chirurgical, une abstention thérapeutique a été décidée pour l’ARCA jusqu’à guérison de la myocardite puis évaluation à l’effort. A 3 mois, l’IRM s’est normalisée avec absence de rehaussement tardif et l’épreuve d’effort s’est révélée normale.
Discussion : la prévalence des anomalies de naissance de la coronaire droite est estimée à 0.32% dont plus de 90% avec trajet interartériel(1). La cause reste inconnue. La présentation clinique peut être variable (asymptomatique, syncope…). La symptomatologie est particulièrement liée aux efforts physiques avant l’âge de 30 ans. Le diagnostic repose sur le scanner coronaire (2). Le risque de mort subite est le plus important à considérer notamment dans les formes interartérielles et lors d’efforts intenses. Le traitement chirurgical (par réimplantation de l’ostium coronaire) peut se discuter chez les sujets symptomatiques (algorithme décisionnel proposé par le groupe ANOCOR). Chez les patients porteurs d’une ARCA asymptomatique, seuls les sports de classe IA après test d’effort négatif sont autorisés (3).
Bibliographie
1. Cheezum MK, Liberthson RR, Shah NR, Villines TC, O’Gara PT, Landzberg MJ, et al. Anomalous Aortic Origin of a Coronary Artery From the Inappropriate Sinus of Valsalva. J Am Coll Cardiol. 28 mars 2017;69(12):1592‑608.
2. Newer concepts for imaging anomalous aortic origin of the coronary arteries in adults. – PubMed – NCBI. Disponible sur: https://www.ncbi.nlm.nih.gov/pubmed/17486584
3. Borjesson M, Dellborg M, Niebauer J, LaGerche A, Schmied C, Solberg EE, et al. Recommendations for participation in leisure time or competitive sports in athletes-patients with coronary artery disease: a position statement from the Sports Cardiology Section of the European Association of Preventive Cardiology (EAPC). Eur Heart J. 1 janv 2019;40(1):13‑8.
*Auteur Correspondant : emmail@hotmail.fr
Pas de conflit d’intérêt
7/ Faisabilité et sécurité de l’angioplastie du tronc commun en ambulatoire : Expérience monocentrique initiale
Laetitia NEUVILLERS1, Christophe CAUSSIN1, Aurélie VEUGEOIS1, Antoine VAILLIER1, Luc DRIEU1, Zoheir MAMI1, Quentin LANDOLFF1, Alain DIBIE1, Alice OHANESSIAN1, Philippe GOY1, Anastasia SOKOLOFF1, Khalil MAHMOUDI1, Nicolas AMABILE1
1 Institut Mutualiste Montsouris, 42 Bd Jourdan, 75014 PARIS.
Introduction : L’angioplastie ambulatoire est devenue le gold standard pour la prise en charge des lésions coronaires simples ; la faisabilité des lésions complexes qui intéressent le tronc commun reste encore peu étudiée. L’objectif de notre étude rétrospective, monocentrique, est d’étudier le pronostic des patients dilatés sur le tronc commun en hôpital de jour par rapport aux patients hospitalisés.
Matériel et méthode : Nous avons inclus tous les patients ayant bénéficié d’une angioplastie du tronc commun entre janvier 2018 et décembre 2019. Le critère de jugement principal était un critère composite de décès cardiovasculaires, AVC ischémiques, infarctus, revascularisation du tronc commun à 30 jours. Les critères de jugement secondaires étaient la survie sans évènement à 12 mois, les saignements graves (BARC>2) à 30 jours.
Tous les patients ont été rappelés, à défaut la dernière consultation médicale était renseignée. Les patients ambulatoires avaient une biologie 48 heures avant, ils étaient télémétrés pendant 6 heures après l’angioplastie, la sortie était à la discrétion de l’opérateur.
Résultats : Au total, 229 patients ont été inclus, dont 14 avaient bénéficié d’une angioplastie en hôpital de jour et 215 en hospitalisation. Le suivi moyen était de 366 jours, 1 seul patient était perdu de vue.
Les patients ambulatoires avaient un âge médian de 65 ans contre 75 ans chez les patients hospitalisés (p=0.02), aucun n’avait de syndrome coronarien (0 vs. 56 ; p=0,02), le Syntax score médian était de 18 contre 21 (p = 0,02). Seulement trois patients ambulatoires étaient pontés (21% contre 16%, p=0.71).
Le nombre de stents total et la longueur des stents dans le tronc commun était moins importants en ambulatoire (p=0,05). L’utilisation de l’imagerie endocoronaire (21% versus 23%, p=0.59), de l’athérectomie rotative (7% versus 6%, p=0.57) et de la voie fémorale (14% versus 23%, p=0.36) était similaire entre les deux groupes.
Le critère de jugement principal est survenu chez 0 patients dans le groupe ambulatoire contre 13 patients dans le groupe hospitalisé (0% vs. 6% ; p=0.43).
La survie sans évènements à 12 mois de l’ensemble des patients dilatés sur le tronc commun était de 87,1%. Elle était de 90,9 % (89,2–99,6 ; n=1/14) dans le groupe ambulatoire contre 86,7 % (84,3–89,2 ; n=21/215) ; p=0,51 dans le groupe hospitalisé. Un patient ambulatoire avait été revascularisé à 180 jours sur une resténose ostiale de l’artère circonflexe.
Une hémorragie grave est survenue à 30 jours chez 1 patient ambulatoire contre 18 patients hospitalisés ; p=0.80.
Conclusion : Notre série montre la faisabilité de l’angioplastie ambulatoire du tronc commun et permet de mieux définir le profil des patients qui pourront en bénéficier.
*Auteur Correspondant : Laetitia.Neuvillers@imm.fr
Pas de conflit d’intérêt
INSUFFISANCE CARDIAQUE
8/ Insuffisance cardiaque à haut débit secondaire à une malformation artério-veineuse pelvienne
C. MONNIN1*, B. GUILLON1, P. COSTA2
1 Service de Cardiologie, CHU Jean Minjoz BESANCON 25 000
2 Service de Médecine Vasculaire, CHU Jean Minjoz BESANCON 25 000
Mots Clés : Malformation arterio-veineuse, Insuffisance cardiaque à haut débit
Key Words : Arteriovenous malformation, High Output Heart Failure
Background : L’insuffisance cardiaque à haut débit (ICHD) se définit par un index cardiaque à 4 L/min/m2 associé à des symptômes d’insuffisance cardiaque (1). Les causes les plus communes sont l’obésité, la cirrhose hépatique, les pathologies pulmonaires chroniques, les syndromes myéloprolifératifs et les shunts extra cardiaques qui représentent à eux seuls 22% des cas (1). Ces shunts sont de différentes natures : fistules artério-veineuses artificielles de dialyse ou post-traumatiques, shunts pulmonaires de la maladie de Rendu Osler, shunt arterio-porte consécutifs à un hémangiome hépatique, ou encore les malformations atério-veineuse (MAV) abdomino-pelviennes.
Cas Clinique : Nous rapportons le cas d’une femme de 44 ans qui présente une MAV pelvienne gauche découverte fortuitement en 2017 à l’occasion d’une grossesse. Après échec d’un traitement endovasculaire, la patiente asymptomatique est alors perdue de vue.
Elle consulte 3 ans plus tard pour dyspnée d’effort progressive évoluant depuis 6 mois au stade NYHA III. L’examen clinique révèle un souffle systolique diffus à 3/6 sans signe d’insuffisance cardiaque gauche ou droite. Le bilan biologique montre une TSH normale, Hémoglobine à 13g/dL, BHCG négatif, BNP à 100 pg/ml. L’ECG est normal. L’échographie cardiaque met en évidence une dilatation ventriculaire gauche avec DTDVG mesuré à 64 mm (Figure 1), FEVG conservée, Débit cardiaque échographique mesuré à 13 L/min sur le flux d’ITV sous aortique, absence de valvulopathie, les PAPS sont estimées à 45 mmHg. Ces données sont confirmées par un cathétérisme cardiaque droit montrant un hyperdébit à 15,76 L/min selon la méthode de Fick soit Index cardiaque à 8,4 L/min/m2, associé à une hypertension pulmonaire post-capillaire non disproportionnée (RVP à 1 UW) avec PAPm à 34 mmHg et PAPO à 19 mmHg. Les oxymétries étagées éliminent un shunt intra-cardiaque. Un nouvel angioscanner abdomino-pelvien retrouve une volumineuse MAV de près de 9 cm de grand axe (Figures 3 et 4). L’échographie doppler confirme la présence d’un hyperdébit au niveau de la MAV (Figure 2).
Après deux échecs de fermeture de MAV par procédures endovasculaires, et la persistance de la symptomatologie ainsi que de l’hyperdébit échographique, la patiente a été adressée à un centre spécialisé parisien.
Discussion : Les shunts extra cardiaques constituent la 3ème cause d’ICHD. La baisse des résistances vasculaires systémiques est au centre du processus physiopathologique et est aussi corrélée au mauvais pronostic de l’ICHD. Les shunts sont par ailleurs associés à une mortalité plus importante que les autres causes d’ICHD (1). Les MAV pelviennes sporadiques sont rares et se manifestent le plus souvent par des signes d’insuffisance cardiaque (2). La fermeture de ces shunts est le traitement curatif de l’ICHD. Peu d’hyperdébit de cette ampleur ont été décrits dans la littérature (1).
Conclusion : Les shunts extra cardiaques représentent une cause importante d’ICHD dont le pronostic est plus sévère. Certains de ces shunts comme les MAV pelvienne sont accessibles à un traitement de fermeture curateur de l’ICHD.
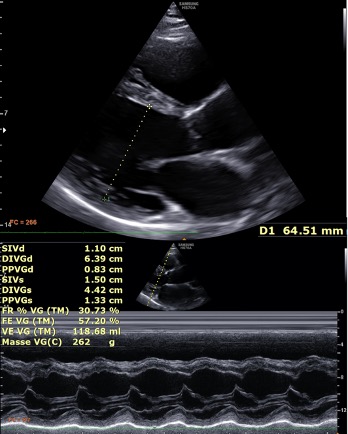
Figure 1 : ETT en coupe parasternale grand axe montrant une dilatation ventriculaire gauche.
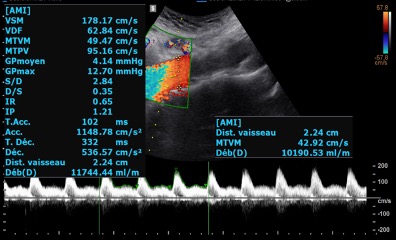
Figure 2 : Mesure du débit de la MAV par Echographie Doppler.
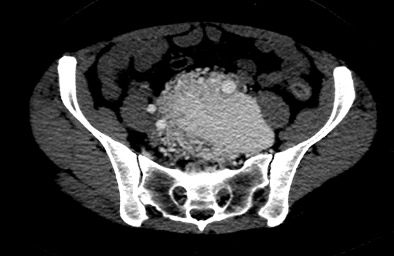
Figure 3 : Coupe scannographique en reconstruction axiale injecté au temps artériel montrant une volumineuse MAV pelvienne.
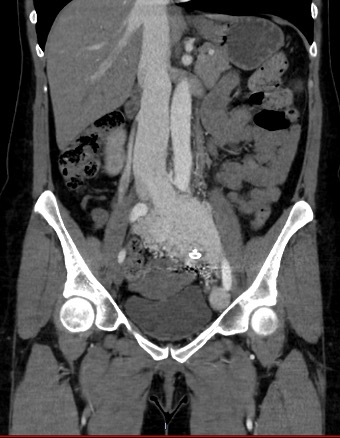
Figure 4 : Coupe scannographique en reconstruction coronale injecté au temps artériel montrant une importante MAV pelvienne avec opacification et dilatation veineuse iliaque gauche majeure.
Bibliographie :
1. Reddy et al. High Output Heart Failure JACC 2016
2. A. Aymard et al. Malformation arterio-veineuse de l’abdomen et du pelvis LPM 2019
*Auteur Correspondant : charlesm1@live.fr
Pas de conflit d’intérêt
RYTHMOLOGIE
9/ Fibrillation atriale et allongement du QT sur hypomagnésémie secondaire à un traitement par inhibiteur de la pompe à protons
N. Noirclerc1, C. Delfanne1, A. Dompnier1
1 Centre Hospitalier Annecy Genevois, 1 Avenue de l’hôpital, 74370 Metz-Tessy
Introduction : Les inhibiteurs de la pompe à protons (IPP) sont des traitements largement prescrits, cependant leur utilisation prolongée expose à des effets secondaires, dont certains sont peu connus comme l’hypomagnésémie [1]. L’hypomagnésémie peut se manifester par des complications cardiaques à type de troubles du rythme supra-ventriculaire ou d’allongement de l’intervalle QT avec risque de torsade de pointe [2].
Examen clinique : Un patient de 65 ans aux antécédents de tabagisme actif, d’hypertension artérielle sous aténolol, périndopril et indapamide, d’infarctus du myocarde inférieur cinq ans auparavant traité par angioplastie, sous aspirine, prasugrel et atorvastatine, et d’ulcère gastrique ancien sous pantoprazole au long cours, consulte aux urgences pour palpitations. Sa dernière consultation cardiologique remonte à quatre ans, ce pourquoi il est toujours sous prasugrel. Le patient ne rapporte pas de symptôme digestif et aucune anomalie n’est décelée à l’examen clinique, en particulier neurologique. L’électrocardiogramme (ECG) révèle une fibrillation atriale (FA) avec cadence ventriculaire rapide à 150 battements par minute des QRS fins avec des onde Q séquellaires en inférieur et une extrasystole ventriculaire (Figure 1). La biologie révèle une hypomagnésémie sévère à 0,31 mmol/L (pour une norme entre 0,7 et 1,1 mmol/L), une hypocalcémie corrigée par l’albumine à 1,65 mmol/L (pour une norme entre 2,2 et 2,6 mmol/L) secondaire à l’hypomagnésémie et aggravée par une carence en vitamine D à 7,3 ng/mL (norme > 30ng/mL). Le reste du bilan biologique est normal (hémoglobine, créatinine, kaliémie, phosphorémie, TSH et troponine). Après correction de l’hypomagnésémie par sulfate de magnésium et de l’hypocalcémie par gluconate de calcium, l’arythmie se réduit en rythme sinusal à 60 par min avec un bloc auriculo-ventriculaire de type 1, des QRS fins et un allongement du QT corrigé à 520 ms (Figure 2). Un traitement d’entretien par sulfate de magnésium permet de normaliser le QT en 48h. Le bilan étiologique de l’hypomagnésémie retrouve deux mécanismes : la prise d’un traitement IPP (le pantoprazole) et à moindre mesure la prise d’un traitement apparenté à un diurétique thiazidique (l’indapamide). Le traitement par pantoprazole est arrêté, et une supplémentation en calcium et en vitamine D est instaurée.
Discussion : En augmentant le pH dans la lumière intestinale, les IPP bloqueraient l’absorption intestinale du magnésium en diminuant son affinité pour les récepteurs à la mélastine TRPM 6 et 7 [1]. Les patients nécessitant un traitement pour un ulcère ou un reflux gastro-œsophagien pourraient bénéficier en remplacement d’un traitement par antagoniste des récepteurs H2, ceux-ci n’étant pas pourvoyeurs d’hypomagnésémie. Concernant les diurétiques apparentés aux thiazidiques, leur action est d’inhiber le cotransporteur Na/Cl localisé dans le tubule contourné distal. Il en résulte une inhibition de la réabsorption du sodium et du magnésium à ce niveau de façon active et passive [3].
Conclusion : L’association d’une FA paroxystique et d’un allongement du QT post réduction est très évocatrice de la présence de troubles ioniques. L’hypomagnésémie iatrogène secondaire à un traitement par IPP est une entité à ne pas méconnaître. Cette classe thérapeutique largement utilisée peut être responsable d’effets indésirables qui ne doivent pas être sous-estimés.
Références
1. William JH, Danziger J. Magnesium Deficiency and Proton-Pump Inhibitor Use: A Clinical
Review. J Clin Pharmacol. juin 2016;56(6):660‑8.
2. El-Sherif N, Turitto G. Electrolyte disorders and arrhythmogenesis. Cardiol J. 2011;18(3):233‑45.
3. Kieboom BCT, Zietse R, Ikram MA, Hoorn EJ, Stricker BH. Thiazide but not loop diuretics is associated with hypomagnesaemia in the general population. Pharmacoepidemiol Drug Saf.
nov 2018;27(11):1166‑73.
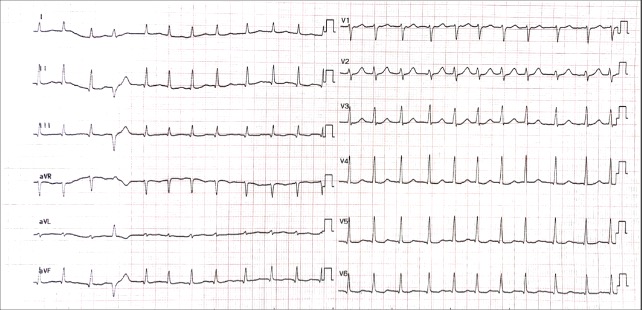
Figure 1. Électrocardiogramme initial montrant une fibrillation atriale et une extrasystole ventriculaire
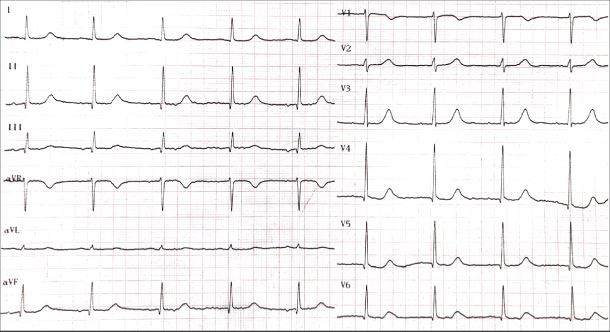
Figure 2. Électrocardiogramme en rythme sinusal montrant un allongement du QT corrigé
*Auteur Correspondant : nathalie.noirclerc@gmail.com
Pas de conflit d’intérêt
VALVULOPATHIE
10/ Insuffisance aortique post traumatique : à propos d’un cas
BOUCHOT Océane1, JOST TURRILLOT Sandra1
1 Service de Cardiologie, Centre Hospitalier Annecy Genevois, 74370 Epagny Metz-Tessy
Introduction : Lucas, 17 ans, sans antécédent, est hospitalisé au déchoquage pour polytraumatisme suite à un accident sur la voie publique en scooter.
Examen clinique : A l’admission, le patient présente une bonne hémodynamique, une douleur sternale, un hématome périorbitaire droit et une plaie du cuir chevelu. Le bilan lésionnel scannographique retrouve une fracture du massif facial Le Fort I, des os propres du nez, du dôme hépatique, un pneumothorax bilatéral minime, des contusions parenchymateuses pulmonaires bilatérales. A la biologie : Hb 129 g/L, troponines 0,84 µg/L (<0,06 µg/L), CPK 439 UI/L, cytolyse 6N, TP 67%. Une surveillance simple en soins intensifs est préconisée, le patient rentre à domicile 7 jours après, l’évolution est favorable.
4 jours après sa sortie, Lucas consulte pour une dyspnée d’effort, l’examen retrouve une pression artérielle 132/45 mmHg, un souffle diastolique aortique. L’ECG est normal, l’ETT découvre une insuffisance aortique sévère excentrée, VG non dilaté, pas de dilatation de l’aorte, FEVG 63%, bon VD, pas d’hypertension pulmonaire. Biologie : BNP 19 ng/L, Hb 129 g/L, ASAT ALAT normalisées, troponines non dosées. Un angioscanner aortique élimine un syndrome aortique aigu, retrouve un défect sur la cusp non coronaire (NC) (Figure 1). L’échographie transoesophagienne (ETO) confirme une insuffisance aortique sévère sur une désinsertion de la cusp NC (Figure 2). L’indication chirurgicale est retenue, un contrôle scannographique rassurant de la fracture hépatique autorise une circulation extra-corporelle (CEC) 72 heures après sa réadmission. Une contusion pariétale antérieure et postérieure de l’aorte thoracique ascendante, sans dissection ni hématome disséquant, est constatée en per opératoire et le chirurgien confirme le mécanisme de désinsertion (Figure 3). La valve sous-jacente est saine, autorisant la plastie : la cusp NC est réinsérée via l’interposition d’un patch péricardique hétérologue St Jude au niveau de l’anneau aortique. Les suites post opératoires sont simples. L’échographie à un an montre un bon résultat de la plastie aortique.
Discussion : Les traumatismes thoraciques à haute cinétique sont pourvoyeurs de lésions cardiovasculaires (1) : contusion myocardique, atteinte de l’aorte thoracique, insuffisance valvulaire. La valve aortique est la valve la plus touchée (2) : par dissection rétrograde ou par augmentation brutale de la pression intraaortique (maximale en début de diastole, valve fermée) qui n’est pas amortie par le flux sanguin et qui entraine un déchirement valvulaire (1). La fast echo a son intérêt à l’admission pour éliminer un épanchement ou une dissection, les valvulopathies sont plus difficiles à visualiser pour un opérateur non entrainé. L’ETO est l’examen de choix pour caractériser la valvulopathie et évaluer les chances de réparation. Le traitement est majoritairement chirurgical ; le délai dépendra de la tolérance et des lésions associées parfois sévères chez ces patients polytraumatisés (risque hémorragique de la CEC). De bons résultats à moyen terme de ces plasties sur fuites post traumatiques ont été rapportés (3).
Conclusion : Les atteintes valvulaires doivent être recherchées après un traumatisme thoracique. La réparation est le traitement chirurgical de premier choix lorsque cela est possible chez des patients souvent jeunes. La durabilité de ces plasties sur le long terme reste à confirmer.
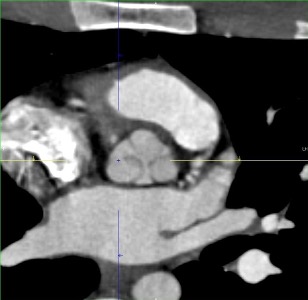
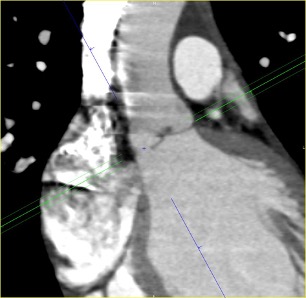
Figure 1A et 1B. Angioscanner aortique montrant un défect au niveau de la cusp non coronaire suspect d’une déhiscence valvulaire
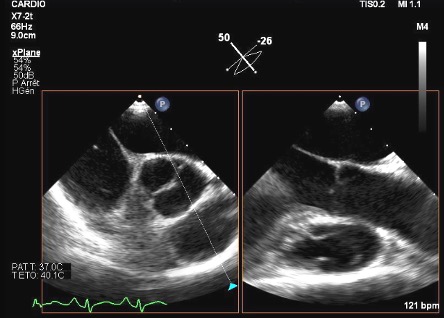
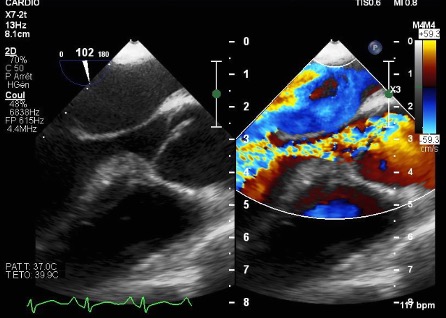
Figure 2. ETO coupe petit axe et grand axe montrant la désinsertion de la cusp non coronaire au niveau la commissure non coronaire/coronaire gauche avec perte de coaptation responsable d’une insuffisance aortique sévère
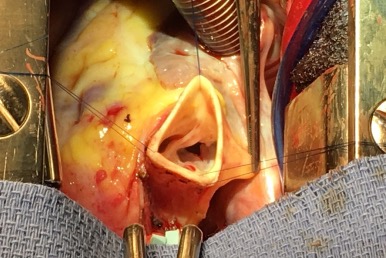
Figure 3. Vue per opératoire montrant la désinsertion et perforation de la cusp non coronaire
Bibliographie :
1. Prêtre R, Chilcott M. Blunt trauma to the heart and greatvessels. N Engl J Med 1997 ; 336 : 626–632.
2. Liu N, Orliaguet G. Traumatismes cardiaques.In :BeydonL,Carli P, Riou B, eds. Traumatismes graves. Rueil-Malmaison : Arnette, 2002 : 341-58.
3. Meunier JP et al. Traumatic aortic regurgitation: diagnostic, management and treatment Arch Mal Coeur Vaiss. 2004 Jun ; 97 (6) : 613-8.
*Auteur Correspondant : obouchot@ch-annecygenevois.fr
Pas de conflit d’intérêt
